Barnes i jego współpracownicy szacują, że 40% populacji amerykańskiej cierpi na zaburzenia czynności tarczycy , a jej niedoczynność jest najczęstszym powodem narzekań pacjentów, zaobserwowanym przez lekarzy w tym kraju. Kilka czynników przyczynia się do klinicznych zaburzeń czynności tarczycy, należą do nich choroby wpływające na sam gruczoł lub zaburzenia na drodze podwzgórze – przysadka – oś tarczycy. Subkliniczna (utajona) dysfunkcja tarczycy, a zwłaszcza jej niedoczynność, jest bardziej powszechna niż patologia kliniczna. (…)
Choroby związane z niedoczynnością tarczycy
Ciężka, kliniczna niewydolność tarczycy związana jest z wieloma chorobami, do których zaliczamy obrzęk śluzowaty, kretynizm u dzieci, wole, miażdżycę i hiperlipidemię. Subkliniczna niedoczynność tarczycy jest bardziej powszechna i nie zawsze jest łatwa do wykrycia w ramach zwykłych procedur testowych. Niedoczynność utajona (subkliniczna) powinna być opisana jako syndrom, a nie choroba, a charakteryzują ją: zmęczenie, depresja, wrażliwość na zimno, zmiany skórne oraz zmiany w strukturze włosów. Postępujące zmęczenie jest zwykle pozorne niewinne, wynikające z wymogu dodatkowego snu. Często może rozwinąć się też depresja, która staje się coraz dłuższa z każdym epizodzie. Wrażliwość na zimno najpierw pojawia się w kończynach. Zimno w dłoniach i stopach może być odczuwalne nawet latem. Skóra staje się sucha, a włosy szorstkie lub cienkie z tendencją do wypadania.
Niedobory odżywcze a niedoczynność tarczycy
Znanych jest wiele niedoborów żywieniowych, które rozwijają się w subklinicznej niedoczynności tarczycy. Najbardziej rozpoznanym jest niedobór żelaza. Wynikająca z niego anemia może występować w postaci normochromatycznej, normocytarnej, hipochromicznej, mikrocytarnej, makrocytarnej lub megaloblastycznej. Częstość występowania niedokrwistości szacuje się aż u 60% pacjentów z niedoczynnością tarczycy i nie jest ona powiązana z nasileniem i czasem trwania tej niewydolności. Inne pokrewne do niedoczynności tarczycy braki, to niedobór białka, być może ze względu na towarzyszącą hipochlorhydrię (deficyt kwasu solnego w soku żołądkowym), niedobór witamin: A, C, B6, B5, B1 oraz minerałów: fosforu (P), manganu (Mn), magnezu (Mg), potasu (K), sodu (Na) i chromu (Cr). Keyvani i jego współpracownicy odkryli, że niskie poziomy witaminy A są powiązane ze wzrostem częstotliwości występowania wola u osób poniżej 18 roku życia. Po 18 roku życia wole występuje częściej u kobiet niż u mężczyzn, u których zauważono wyższy poziom witaminy A. Przewagę występowania wola u kobiet można tłumaczyć zwiększoną wrażliwością tkanek na estrogen w obecności niedoboru witaminy A. U dzieci ze zdiagnozowanym 1 stopniem wola zaobserwowano również niedobór cynku w połączeniu z niedoborem witaminy A.
Badanie EHA określa poziomy żelaza, fosforu, manganu, magnezu, potasu, sodu oraz chromu w Twoim organizmie.
Inhibitory tarczycy
Przede wszystkim powinniśmy dokonać przeglądu niektórych naturalnie występujących inhibitorów tarczycy. Zazwyczaj nie są one brane pod uwagę w leczeniu, co może wyjaśniać często powolną reakcję pacjentów na przyjmowanie syntetycznych preparatów hormonów tarczycy. Pacjenci, którym przypisywane są te preparaty lub tyroksyna, najczęściej nie reagują na leczenie przez okres pierwszych sześciu miesięcy. Wzięcie pod rozwagę tych znanych inhibitorów tarczycy może zaowocować szybszą reakcją na leki. Wykres 1 przedstawia wiele czynników odżywczych, które są znane z antagonizowania czynności tarczycy. (…)
Witamina B12, Kobalt (Co)
Kobalt i witamina B12 są ściśle ze sobą powiązane. Dlatego też, każde z nich może mieć niekorzystny wpływ na tarczycę i przyczyniać się do jej niedoczynności. Wpływ kobaltu na tarczycę zaobserwowano u pacjentów z anemią, których leczono kobaltem.
Badanie EHA określa poziom kobaltu oraz jego stosunek do potasu i żelaza w Twoim organizmie.
Witamina D, Wapń (Ca)
Hamujący wpływ wapnia na tarczycę podejrzewano od ubiegłego wieku, ale późniejsze badania potwierdziły ten fakt. Wiadomo, że wapń zmniejsza aktywność tarczycy i że absorpcja wapnia jest zwiększona u pacjentów z niewydolnością tarczycy. Również witamina D, ze względu na swój ścisły, synergiczny związek do wapnia, brana jest pod uwagę, jako czynnik obniżający funkcję tarczycy. Badania wykazały, że metabolity witaminy D3 w surowicy są podwyższone u pacjentów z niedoczynnością i zmniejszone u pacjentów z nadczynnością tarczycy. (…)
Badanie EHA określa poziom wapnia oraz jego stosunek do magnezu, fosforu, potasu, sodu, krzemu oraz żelaza w Twoim organizmie.
Lit (Li)
Niedoczynność tarczycy, jest także dobrze znanym skutkiem ubocznym terapii litem. Lit w widoczny sposób wpływa również na wapń. Badania wykazały, że u pacjentów poddanych terapii litem, stężenia wapnia w surowicy krwi wzrośnie, natomiast fosforu zostanie obniżone, co jest prawdopodobnie spowodowane nadczynnością tarczycy, wywołaną przez lit, o czym donosił Shen i jego współpracownicy. (…)
Badanie EHA określa poziom litu oraz jego stosunek do potasu w Twoim organizmie.
Jod (I)
Jod jest niezbędny do prawidłowego funkcjonowania tarczycy, ale przy nadmiernym spożyciu staje się czynnikiem tłumiącym jej pracę. Stwierdzono, że występowanie wola endemicznego w Chinach, jest spowodowane wysokim stężeniem jodu w wodzie pitnej. Jod od dawna jest stosowany w terapii i leczeniu nadczynności tarczycy.
Badanie EHA określa poziom jodu w Twoim organizmie.
Miedź (Cu)
Miedź, z powodu bliskiej relacji z estrogenem (która omawiana będzie później) oraz antagonistyczny stosunek do żelaza i cynku, może być rozważana jako pierwiastek zakłócający prawidłową pracę tarczycy. Cecil opisał związek niedoczynności tarczycy z niedoborem żelaza. Nowsze badania wykazały, że niedobór żelaza może upośledzać czynność tarczycy i że status, jaki posiada ten pierwiastek w organizmie może odzwierciedlać jej aktywność. Zauważono również, że podczas niedoboru żelaza, konwersja L-fenyloalaniny do L-tyrozyny zmniejsza się nawet o 50%.
Badanie EHA określa poziom miedzi oraz jego stosunek do cynku oraz żelaza w Twoim organizmie.
Inhibitory hormonów tarczycy
Do niedoczynności tarczycy może przyczynić się nadmierna aktywność innych gruczołów dokrewnych. Wzrost hormonów będących w obiegu, nawet wtedy, gdy są w normalnych granicach serologicznych, może hamować lub zmniejszać odpowiedź na leczenie tarczycy. Gruczoły wydzielania wewnętrznego wykazują przeciwną aktywność, podobnie do witamin i minerałów. Ich nadaktywność może tłumić przeciwny gruczoł, a niedoczynność może umożliwić jego zwiększoną ekspresję.
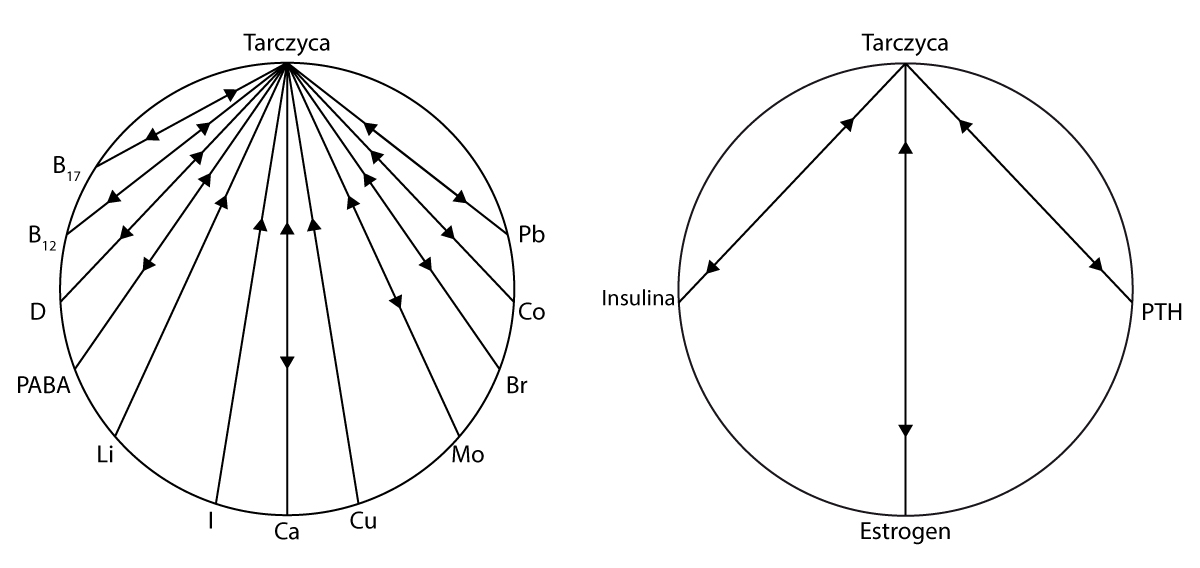
Estrogen
Estrogen jest ściśle powiązany z miedzią, z którą wykazuje tendencje do jednoczesnych wahań w surowicy krwi. Jest wysoce prawdopodobne, że estrogen, jak i miedź, hamują aktywność tarczycy. Estrogen jest znany ze zmniejszania produkcji hormonu tyreotropowego (TSH) przez przysadkę. Podczas ciąży, kiedy poziom estrogenu i miedzi wzrasta, częstym zjawiskiem jest powiększenie tarczycy. Wiadomo również, iż ciąża łagodzi nadczynność tarczycy.
Insulina
Insulina jest znana, jako konkurencyjna do produkcji tyroksyny. Poziom insuliny w osoczu, który wzrasta podczas trwania ciąży wraz ze wzrostem poziomu estrogenu wzrasta również podczas terapii estrogenem. Insulina wspiera syntezę witaminy D i odwrotnie, witamina D zwiększa syntezę insuliny. Częstość występowania niewydolności tarczycy u diabetyków leczonych insuliną staje się coraz bardziej rozpoznawana. Wyniki badań tego związku raportował Gray wraz ze współpracownikami. Niedoczynność tarczycy jest najczęstszym zaburzeniem gospodarki hormonalnej u dzieci. (…)
Wapń jest znanym czynnikiem ułatwiającym uwalnianie insuliny. Synergizm między wapniem a witaminą D może przyczynić się do zmniejszenia aktywności tarczycy, albo poprzez stymulację insuliną, albo ze względu na antagonizm wapnia i witaminy D do innych składników odżywczych, które są niezbędne do normalnego funkcjonowania tarczycy.
Parathormon (PTH)
Hormonalna aktywność PTH zwiększa absorpcję i retencję wapnia, a tym samym zwiększa produkcję insuliny. Aktywność PTH jest także zwiększana przez witaminę D i odwrotnie.
Tarczyca i gruczoły przytarczyc zdają się wykazywać odwrotne działanie. Pacjenci z niedoczynnością tarczycy często okazują się mieć subklinicznie podwyższony poziom hormonu PTH w obecności normalnego poziomu wapnia w surowicy. Wydzielanie hormonu PTH zwiększa się przez estrogen.
Insulina, estrogen i PTH mogą być brane pod uwagę, jako wzajemni synergiści. Mogą one pojedynczo lub zbiorowo wywierać konkurencyjny lub antagonistyczny wpływ na pracę tarczycy.
Należy pamiętać, że również zwiększona aktywność tarczycy może zmniejszać aktywność przeciwstawnych do niej gruczołów. (…)
Analiza mineralna tkanek (Tissue Mineral Analysis TMA), wzory wyników i dysfunkcje tarczycy
Gruczoły wydzielania wewnętrznego (hormony) wpływają na metabolizm pierwiastków śladowych, a pierwiastki śladowe mają wpływ na funkcje wydzielania wewnętrznego. Dlatego też, wzory wyników TMA mogą okazać się przydatne w ocenie aktywności hormonalnej. Wzór wyniku TMA, który świadczy o niedoczynności tarczycy, jest związany z zaburzeniem w następujących proporcjach mineralnych: wapń/fosfor (Ca/P), wapń/potas (Ca/K), wapń/magnez (Ca/Mg) i sód/ magnez (Na/Mg).
Stosunek Ca/P jest podwyższony ponad normę. Było to łatwe do przewidzenia, ponieważ jak omówiono wcześniej, w niedoczynności tarczycy absorpcja wapnia wzrasta, podczas gdy resorpcja fosforu przez nerki jest zmniejszona. Wzrost aktywności PTH również jest widoczny we wzorze TMA. PTH zwiększa wchłanianie wapnia i magnezu, zmniejszając jednocześnie poziom fosforu w nerkach, podobnie jak sodu i potasu. Stosunek Ca/Mg może zostać podwyższony w zależności od stopnia udziału PTH.
Zredukowana aktywność nadnerczy jest wskazywana przez podniesiony poziom magnezu w stosunku do sodu, tj., obniżony stosunek Na/Mg.
Poziom miedzi często jest podwyższony powyżej normy, co także jest konsekwencją niewydolności nadnerczy.
Wzrost wydzielania insuliny może być odzwierciedlony przez wzrost stosunku Ca/Mg, który koresponduje również ze zwiększoną aktywnością PTH.
W przypadku nadczynności tarczycy, powyższe wskaźniki wykazują odwrotną tendencję w profilach analizy mineralnej tkanek TMA. Wzrost aktywności tarczycy zwiększa wydalanie wapnia i magnezu oraz zatrzymanie fosforu. Jest to efekt antagonizmu tarczyca – przytarczyce, który powoduje redukcję stosunku Ca/P widoczną w wyniku analizy mineralnej tkanek (Tissue Mineral Analysis TMA).
Na wzrost aktywności nadnerczy wskazuje podwyższony stosunek Na/Mg oraz zmniejszona proporcja Ca/K.(…)
Badanie EHA określa proporcje pierwiastków,których zachwianie może świadczyć o zaburzeniach pracy tarczycy. Należą do nich proporcje: wapnia do fosforu, wapnia do potasu, wapnia do magnezu oraz sodu do magnezu.
Zadbaj o swoje zdrowie – wykonaj pierwiastkowe badanie włosa EHA.
Wykorzystano fragmenty artykułu:
David L. Watts, D.C., Ph. D., F.A.C.E.P., The Nutritional Relationships of the Thyroid, Journal of Orthomolecular Medicine, Vol. 4, 1989, No. 3, s. 165-169.
Bibliografia pełnego artykułu:
1. Barnes BO, Galton L: Hypothyroidism: The Unsuspected Illness. Harper and Roe Pub., N.Y.. 1976.
2. Guyton AC: Medical Physiology. W.B. Saunders, Phil., 1971.
3. Fein HG, Rivlin RS: Anemia in thyroid disease. The Medical Clinics of North America Vol. 59. W.B. Saunders Co., Phil., 1975.
4. Keyvani F, Yassai M, Kimiagar M: International symposium on clinical nutrition and post graduate course. Apr., 1987. Am. J. CI. Nutr., 46,3, 1987.
5. White A, Handler P, Smith EL: Principles of Biochemistry. McGraw-Hill, 1964.
6. Yasaai M, et al: Correlations of serum zinc concentrations with goiter, physical development and serum vitamin A levels. International symposium on clinical nutrition and post graduate course. Apr., 1987, San Diego. Am. J. CI. Nutr., 46,3, 1987.
7. Barker MH: The blood cyanates in the treatment of hypertension. J.A.M.A. 106, 1936.
8. National Research Council. Diet, Nutrition and Cancer. Wash. D.C. Nat. Academy Press, 1982.
9. Eyjolfsson R: Recent advances in the chemistry of cyanogenic glycosides. Zechmeister. Progress in the Chemistry of Organic Natural Products, Vol. 28. Springer Pub. N. Y., 1970.
10.Sederholm T, et al: Cobalt-induced hypothyroidism and polycythemia in lipid nephrosis. Acta Med., Scand., 184, 1944.
11. Washburn TC, Kaplan E: Cobalt therapy and goiter. Clin. Ped., 3, 1964.
12. Kriss P, Carnes WH, Gross RT: Hypothyroidism and thyroid hyperplasia in patients treated with cobalt. J.A.M.A. 157, 1955.
13. Greer MA: Nutrition and Goiter. Physiol. Rev. 30, 1950.
14. Greer MA, Kendall JW, Smith M: Antithyroid compounds. The Thyroid Gland, Vol. I. Pitt, Rivers, Trotter, Eds. Butterworths, Lond. 1964.
15. Lowe CE, Bird ED, Thomas WC: Hypercalcemia in myxedema. /. Clin. Endocrinol. Metab., 22, 1962.
16. Mosekilde L, Lund B, Sorensen OH, Chris tensen MS, Melsen F: Serum 25-hydroxy- cholecalciferol in hypothyroidism. Lancet,I, 1977.
17. Valentzas C, Oreopoulos DG, From G, Porret B, Raporport A: Vitamin D levels in thyrotoxicosis. Lancet, 1977.
18. Danowski TS: Clinical Endocrinology Vol II. Williams and Wilkins, Baltimore, 1962.
19. Cox M, Singer I: Lithium. Disorders of Mineral Metabolism, Vol. I. Bronner, F, Cobkurn, J.W., Eds. Academic Press, N.Y., 1981.
20. Shem F-H, Sherrard DJ: Lithium-induced hyperparathyroidism: An alteration of „set-point”. Ann. of Intern. Med., 96, 1982.
21. Langer P, Greer MA: Antithyroid Substances and Naturally Occurring Goitrogens. S. Keager, Basel, Switz., 1977.
22. Mu L: Endemic goiter in central China caused by excessive iodine intake. Lancet II, 1987.
23. Wolf J, Chaikoff IL: Plasma inorganic iodide as a homeostatic regulator of thyroid function. /. Biol. Chem., 174, 1948.
24. Cecil RL: Textbook of Medicine. Saunders Co., Phil. 1938.
25. Dillman E, et al: Hypothermia in iron deficiency due to altered triiodothyronine metabolism. Am. J. Physiol., 239, 1980.
26. Lehmann WO, Henrich HC: Impaired phenylalanine-tyrosine conversion in patients with iron-deficiency anemia studied by a L(2H5phenylalanine loading test. Am. J. Clin. Nutr., 44, 1986.
27. Watts DL: Nutritional interrelationships, minerals, vitamins, endocrines. (Unpub.) Trace Elements, Inc., Dallas. 1988.
28. Brown JHU: Intergration and Coordination of Metabolic Processes. A Systems Approach to Endocrinology. Van Nostrand Reinhold Co., N.Y., 1978.
29. Innerfield R, Hollander CS: Thyroidal complications of pregnancy. The Medical Clinics of North America, Vol. 61. W. B. Saunders Co., Phil., 1977.
30. Ibid.
31. Selenkow HA, Birnbaum MO, Hollander CS: Thyroid function and dysfunction during pregnancy. Clin. Ob. Gyn. 16, 66, 1973.
32. Spellacy WH, Goetz FC: Plasma insulin in normal and late pregnancy. N.E.J.M., 268, 1963. 33.Gershberg H, et al: Glucose tolerance in women receiving an ovulatory suppressant. Diabet., 13, 1964.
34. Cross HS, Peterlik M: Hormonal and ionic control of phosphate in differentiating en-terocy te.
Progress in Clinical and Biological Research, Vol. 168. Epithelial Calcium and Phosphate Transport, Molecular and Cellular Aspect. Bonner F, Peterlik M, Eds. Alan R. Liss, Inc., N.Y., 1984.
35. Gray RS, Smith AF, Clark BF: Hypercholesterolemia in diabetes with clinically unrecognized primary thyroid failure. Horm. Metab. Res., 13, 1981.
36. Hughes JF: Pediatrics. Mosby Co., St. Louis, 1971.
37. Sheard NF, Walker WA: The role of breast milk in the development of the gastrointestinal tract. Nutr. Rev., 46, 1, 1988.
38. Leclereq-Meyer V, et al: Effect of calcium and magnesium on glucagon secretion. Endocrinol, 93, 1977.
39. Malaisse WJ, et al: The stimulus-secretion coupling of glucose-induced insulin release. /. Lab. Clin. Med.
40. Adams P, et al: Parathyroid function in spontaneous primary hypothyroidism. /. Endocrinol., 40, 1968.
41. Bouillon R, DeMoor P: Para-thyroid function in patients with hyper- or hypothyroidism. /. Clin. Endocrinol. 38, 1974.
42. Greenburg C, et al: Parathyroid hormone secretion effect of estradiol and progesterone. Metabol., 36, 2, 1987.
43.Larsen PR: Thyroid-pituitary interaction. N.E.J.M., 306, 1, 1982.
44. Henkin RI: Trace metals in endocrinology. The Medical Clinics of North America, Vol. 60. W.B. Saunders Co., Phil. 1976.
45. Douglas WW, et al: Effects of alkaline earths and other divalent cations on adrenal medullary secretion. /. Physiol., 175, 1964.
46. Harrop GA, et al: Studies on the suprarenal cortex. /. Exp. Med., 58, 1933.
47. Wacker WE, et al: Magnesium Metabolism. N.E.J.M., 259, 1958.
48. Harden R, et al: Phosphate excretion and parathyroid function in thyrotoxicosis. /. Endocrinol., 28, 1964.
49. Bortz W, et al: Differentiation between thyroid and parathyroid causes of hypercalcemia. Ann. Int. Med., 54, 1961.
50. Malamos B, et al: The renal handling of phosphate in thyroid disease. /. Endocrinol. 45, 1969.
51. Rosa RM, et al: Adrenic modulation of extrarenal potassium disposal. N.E.J.M., 302, 1980.
52. Silva P, et al: Sympathetic systems in potassium homeostasis. Am. J. Physiol., 241, 1981.
53. Clausen T, et al: The effect of catecholamines on Na-K transport and membrane potential in the rat soleus muscle. /. Physiol., 270, 1977.















